雄性不育是水稻等作物杂种优势利用的基础,三系法和二系法在水稻生产中发挥了重要作用,也是目前我国水稻杂种优势利用的主要方法。三系法利用质-核互作雄性不育,育性稳定,但杂种优势利用需要恢复系基因恢复其不育性;二系法利用光温敏雄性核不育,不受恢复基因的限制,但存在育性受环境影响而不稳定的风险。利用基因工程手段结合雄性核不育突变体的育种方法有效结合了三系法和二系法的优点(袁隆平院士称之为第三代育种技术),其核心是细胞核雄性不育基因的挖掘。因此,挖掘水稻雄性核不育基因、解析调控机制在水稻杂种优势利用中有着十分重要的作用。西南大学水稻研究所近期连续在植物学领域国际重要期刊发表研究成果(Molecular Plant 1篇、Plant Physiology 2篇),揭示水稻雄性核不育调控的新机制。

2023年3月15日Molecular Plant(IF2021=21.949)在线发表了西南大学水稻研究所题为“UDP-glucose epimerase 1, moonlighting as a transcriptional activator, is essential for tapetum degradation and male fertility in rice”的最新研究成果。该研究鉴定了一个水稻雄性不育突变体osuge1,绒毡层降解延迟,导致完全不育。OsUGE1蛋白能够催化UDP-Glc和UDP-Gal的相互转化,而突变的osuge1蛋白因缺乏UDP-葡萄糖差向异构酶活性,不能催化UDP-Glc和UDP-Gal的相互转化,进而导致osuge1突变体穗部UDP-Gal含量增高、UDP-Glc含量降低。与其他已报道的UGEs的细胞质定位不同,OsUGE1定位在细胞质和细胞核,且具有转录激活活性。通过生化和遗传学实验证明OsUGE1参与了调控水稻绒毡层降解的TIP2-TDR-EAT1转录调控级联反应:OsUGE1调控EAT1的表达,OsUGE1的表达也受到TIP2和TDR的调控。此外,该研究还发现OsUGE1通过直接结合OsUGE1启动子中的E-box元件来调节其自身基因的表达。综上,本研究揭示了一种复杂而精密的新型调控模式,为研究植物雄性发育提供了新的途径(图1)。
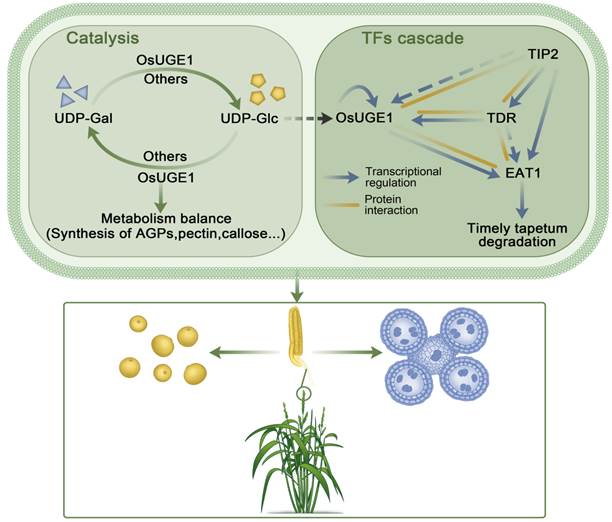
图1. OsUGE1催化UDP-半乳糖与UDP-葡萄糖的相互转化,同时具有转录激活活性,与TIP2、TDR、EAT1共同调控水稻花药绒毡层的降解。
全文地址:https://doi.org/10.1016/j.molp.2023.03.008
https://www.sciencedirect.com/science/article/pii/S1674205223000722

2022年9月16日Plant Physiology (IF2021=8.005) 在线发表了西南大学水稻研究所的题为“POLLEN WALL ABORTION 1 is essential for pollen wall development in rice”的最新研究成果。该研究通过对一个雄性不育突变体pwa1 (pollen wall abortion 1)的研究,发现突变体的花粉内壁缺失,花粉外壁柱状层缺失导致外壁外层和外壁内层融合,最终导致花粉填充失败,完全不育。PWA1编码一个保守的含有CC结构域的表达蛋白,定位于细胞核,在花药的绒毡层和小孢子中均有表达。研究发现,PWA1与花药发育重要转录因子TIP2依赖CC结构域存在互作关系,TIP2直接结合PWA1的启动子调控PWA1的表达,且进一步通过构建双突变体证明了TIP2位于PWA1的上游。研究还发现PWA1具有转录激活活性,并可能通过直接激活花粉内壁形成关键基因Os12BGlu38的表达而参与对花粉内壁的调控(图2)。该研究拓展了水稻花药外壁与花粉壁的发育调控途径。
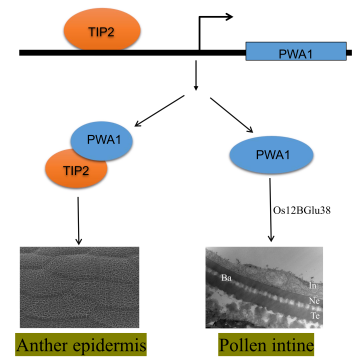
图2. TIP2调控PWA1的表达,并与PWA1互作,共同参与花药外壁的发育;PWA1具有转录激活活性,通过影响Os12BGlu38表达调控花粉内壁的形成。
全文地址:https://doi.org/10.1093/plphys/kiac435

2022年4月19日Plant Physiology ( IF2021=8.005) 在线发表了西南大学水稻研究所的最新研究成果“Oryza sativa PECTIN DEFECTIVE TAPETUM1 affects anther development through a pectin-mediated signaling pathway in rice”。该研究以果胶合成相关的半乳糖醛酸基转移酶突变体oryza sativa pectin defective tapetum1 (ospdt1)为研究对象,发现它的绒毡层细胞程序性死亡(PCD)提前,并产生了完全败育的花粉粒。与其它发生果胶缺陷的突变体不同,ospdt1突变体的果胶含量与野生型差异较小,起结构支撑作用的细胞壁果胶没有明显的缺陷。进一步研究发现WAK家族蛋白OsiWAK1在ospdt1突变体细胞内的分布受到了影响,OsiWAK1的敲除植株与ospdt1突变体出现了相似的绒毡层PCD提前,在ospdt1背景的水稻中超表达OsiWAK1部分恢复了ospdt1的缺陷。因此,该研究认为ospdt1突变体中的果胶合成缺陷影响了OsiWAK1蛋白在细胞内与果胶的整合与运输,进而影响了其功能,并导致绒毡层PCD提前。这一发现为植物体内的果胶如何发挥其生物学功能提供了新的见解(图3)。
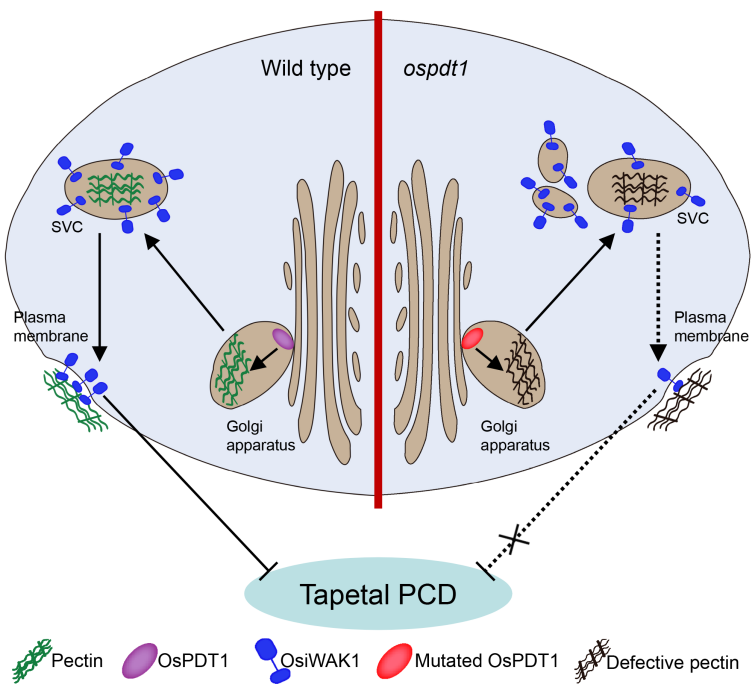
图3:OsPDT1通过果胶合成途径,参与果胶信号元件OsiWAK1的定位与功能调控,最终影响绒毡层细胞的程序化死亡进程。
全文地址 https://doi.org/10.1093/plphys/kiac172